Actualités
UE – Onze autorisations d’OGM demandées le 10 juin 2013
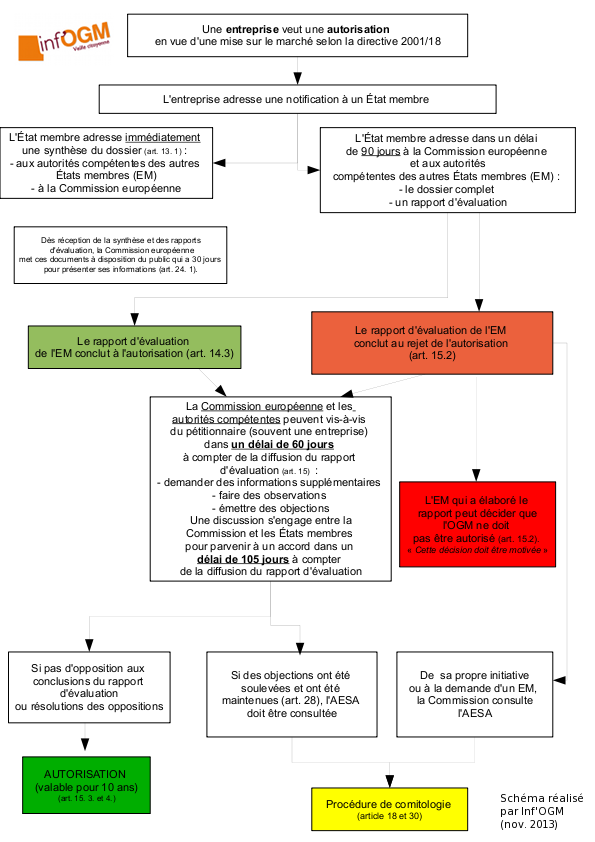
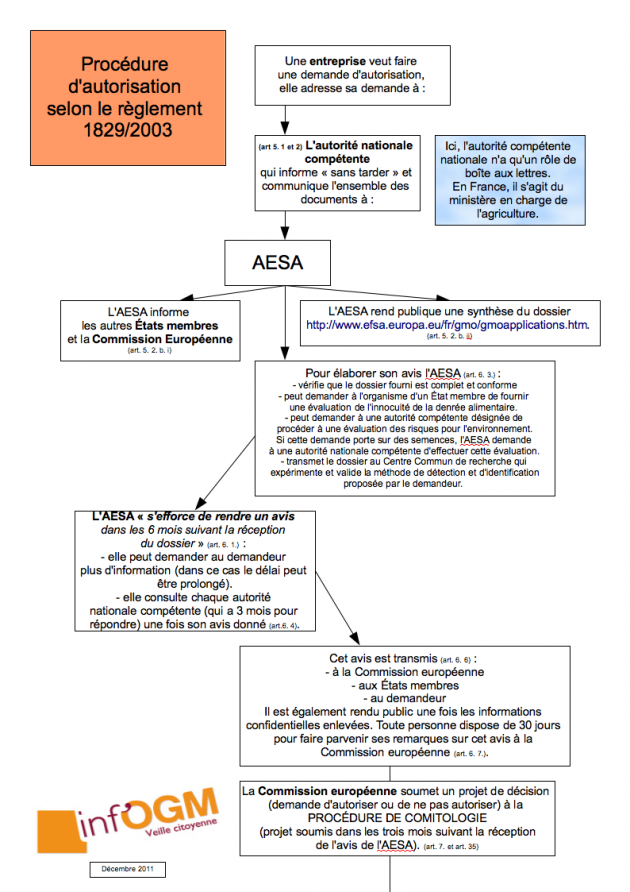
En février 2013, Inf’OGM annonçait la possible autorisation d’une cinquantaine de plantes génétiquement modifiées (PGM) suite à l’adoption d’un règlement européen sur l’évaluation des risques sanitaires liés aux PGM [1]. La Commission européenne est en passe de confirmer cette analyse. Selon l’ordre du jour de la réunion du Comité permanent de la chaîne alimentaire et de la santé animale (CP CASA), prévue le 10 juin 2013, ce sont onze propositions d’autorisations de PGM, réparties en trois paquets, que la Commission européenne soumettra aux représentants des États membres [2]. Toutes concernent l’importation, la transformation et l’alimentation humaine et animale. En cas de vote positif, à la majorité qualifiée, ces propositions deviendront des autorisations effectives.
Le premier paquet concerne le maïs MON89034*1507*NK603 [3] dont la demande a été déposée en 2009 par Monsanto et Dow AgroScience. En 2011, l’Agence européenne de sécurité des aliments (AESA) rendait un avis concluant à l’absence d’impacts alors qu’en France, l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (Anses) rappelait son « avis réservé » lors d’un précédent travail sur l’évènement MON89034 [4].
Le second paquet concerne le maïs Mon89034*1507*MON88017*59122 [5] et ses « sous-combinaisons » dont la demande a été déposée en 2008 par Monsanto. Il a reçu un avis favorable de l’AESA en 2011. En France, aucun avis n’a été rendu par l’Anses ou le HCB [6].
Quant au troisième paquet, il concerne le pollen issu du maïs MON810 [7] dont la demande a été déposée en 2012. Dans son avis, l’AESA écrivait : « Bien que l’AESA ne soit pas en mesure de conclure sur la sécurité du pollen de maïs en général, elle conclut que la modification génétique MON810 ne constitue pas un risque sanitaire supplémentaire si le pollen de maïs MON810 devait remplacer le pollen de maïs non GM dans l’alimentation ou comme aliment » [8]. Une conclusion partagée par l’Anses en juillet 2012.
Particularité des autorisations présentées : l’une d’entre elles concerne neuf PGM qui ont été traitées dans le cadre d’un seul et unique dossier de demande d’autorisation !
La Commission européenne présente en effet une proposition d’autorisation du maïs GM à quatre évènements transgéniques empilés, le maïs Mon89034*1507*MON88017*59122 et de huit maïs GM « liés » car contenant une combinaison de trois ou deux des évènements transgéniques du maïs cité. Sont ainsi concernés :
le maïs Mon89034*1507*MON88017*59122
les maïs « liés » MON89034*1507*MON88017, MON89034*1507*59122, MON89034*MON88017*59122 et 1507*MON88017*59122
les maïs « liés » MON89034x1507, MON89034x59122, 1507xMON88017 et MON88017x59122
Jusqu’à aujourd’hui pourtant, chaque PGM faisait l’objet d’une demande et donc d’une autorisation distincte n’incluant pas les produits des sous-combinaisons. En 2011, un dossier unique pour deux cotons différents avaient d’ailleurs déjà attiré l’attention, celui déposé par Bayer pour les cotons GHB614*LL25*Mon15985 et LL25*Mon15985 [9]. Interrogé à l’époque par Inf’OGM, la Commission européenne nous avait alors confirmé que « deux demandes séparées [étaient] en train d’être demandées à la firme ».
Or, seul un dossier pour le maïs Mon89034*1507*MON88017*59122 a été déposé. Et sur le site internet de l’AESA, aucune trace d’un quelconque avis sur les huit autres PGM !
Si sa légalité reste à confirmer, une telle démarche d’autorisation groupée rejoint l’approche scientifique adoptée dans le cadre de l’évaluation des risques liés aux OGM empilés. Comme nous l’avons déjà vu, la législation prévoit – pour l’évaluation ! – qu’une plante à plusieurs évènements transgéniques ne soit pas évaluée de manière aussi complète que les plantes à un seul événement, si les transgènes ont déjà été évalués. Une approche mise en cause scientifiquement puisqu’elle sous-entend que les gènes fonctionnent indépendamment les uns des autres, une conception bien loin des considérations scientifiques qui ont cours. Il faut préciser que chaque événement transgénique en cause ici (MON89034, TC1507, MON88017, 59122) a déjà fait l’objet d’un avis positif de l’AESA et d’autorisations commerciales.
Côté français en tout cas, le gouvernement a, à sa disposition, l’avis « réservé » de l’Anses sur l’évènement MON89034. Un avis qui l’a conduit à ne pas pouvoir « se prononcer sur la sécurité sanitaire des grains et de leurs produits dérivés issus des maïs hybrides contenant l’évènement MON89034 ». On peut donc s’attendre qu’en toute logique, le gouvernement français vote contre l’autorisation présentée, tant pour le maïs MON89034*1507*NK603 que pour le maïs Mon89034*1507*MON88017*59122.
Après l’adoption du règlement européen en février 2013 sur l’évaluation des risques sanitaires et la décision de ne pas évaluer complètement les PGM empilées, la Commission initie maintenant l’autorisation administrative unique pour plusieurs PGM. L’heure est désormais à l’accélération des autorisations pour l’alimentation humaine et animale.
On peut noter que toutes les sous-combinaisons ne sont pas sujettes à proposition d’autorisation. Ainsi en est-il du maïs MON89034*MON88017 qui fait bel et bien l’objet d’un dossier séparé et qui a été autorisé en 2011 [10]. Quant à savoir pourquoi un traitement séparé pour cette PGM là et pas les autres : mystère… Inf’OGM attend maintenant la réponse de la Commission européenne, interrogée le 7 juin sur ce sujet, quant aux raisons et bases juridiques de ce traitement groupé de neuf PGM combinant des évènements transgéniques.
[1] ,
, « UE – Une cinquantaine de nouveaux OGM autorisés à partir du 25 février ? », Inf’OGM, 22 février 2013
[3] dossier NL/2009/65
[4] , « Maïs MON89034*1507*NK603 », Inf’OGM, 6 novembre 2013
[5] dossier CZ/2008/62
[6] , « Maïs MON89034*1507*MON88017*59122 », Inf’OGM, 6 novembre 2013
[7] dossier NL/2012/107
[8] , « Maïs Mon810 », Inf’OGM, 4 juillet 2017
[9] dossier NL/2011/94,
[10] , « Maïs MON89034*MON88017 », Inf’OGM, 21 août 2013