Actualités
Par son silence, la Commission européenne autorise le maïs Mon810 depuis 15 ans
Le maïs Mon810 est la seule plante OGM transgénique autorisée à la culture commerciale dans l’Union européenne. Cette autorisation fut initialement délivrée, via la France, voici près de 30 ans, en 1998, pour une durée initiale de 10 ans. Une demande de renouvellement fut déposée en 2007. Depuis, aucune décision des instances européennes n’a été prise. Comment ce maïs, dont l’autorisation a théoriquement expiré en 2008, peut-il encore être cultivé légalement en Europe ? Tout simplement parce que le droit européen accepte que, tant que la Commission européenne n’a pas répondu sur une demande de renouvellement, l’autorisation initiale reste valide. A ce jour, cela fait 15 ans que la Commission ne répond pas à Bayer/Monsanto.

Le 4 juillet 2024, la Commission européenne renouvelait pour la 3ème fois l’autorisation commerciale d’importation du maïs transgénique Mon810 pour l’alimentation humaine ou animale1. Moins de 6 mois après avoir reçu un avis favorable de ses experts, la Commission européenne délivrait l’autorisation, témoignant d’une célérité certaine. Mais pour l’autorisation de mise en culture commerciale de ce même maïs, la Commission européenne prend son temps. Bayer/Monsanto attend en effet depuis 15 ans la décision de la Commission européenne de renouveler l’autorisation initiale obtenue en 1998… et expirée en 2008 !
Le droit européen impose un calendrier pour les demandes
Ancien temps, ancienne procédure. Le 22 avril 19982, la Commission européenne donnait à la France, pays ayant reçu la demande initiale, le feu vert pour autoriser à l’échelle européenne la mise en culture commerciale du maïs transgénique Mon810. Cette autorisation était demandée par Monsanto, qui avait génétiquement modifié une lignée de maïs pour qu’elle produise une protéine insecticide contre la pyrale et la sésamie. Le 3 août 19983, le gouvernement français délivrait donc un consentement à cette mise en culture commerciale. L’autorisation délivrée à Monsanto était de 10 ans, valable donc jusqu’en 2008.
Par la suite, les textes de loi européens sur les OGM ont changé, avec l’adoption de la directive 2001/18 ou encore le règlement 1829/2003. Ce dernier est devenu référent dans le dossier du maïs Mon810, car Monsanto a choisi de suivre la procédure administrative que ce règlement établit. Le règlement 1829/2003 imposait à Monsanto de demander le renouvellement de son autorisation obtenue en 1998 au plus tard un an avant l’expiration de cette dernière, soit avant le 2 août 20074. Un calendrier que l’entreprise a respecté puisqu’elle déposait sa demande de renouvellement d’autorisation de mise en culture du maïs Mon810 sur le bureau de la Commission européenne le 4 mai 20075. A partir de cette date, la Commission européenne a très rapidement transmis le dossier de la demande de renouvellement d’autorisation à l’Autorité européenne de sécurité des aliments (AESA), le 18 juin 20076.
Deux ans pour évaluer les risques… et dix pour un vote ?!
L’AESA aura pris « seulement » deux ans pour évaluer les risques liés à la mise en culture du maïs Mon810. C’est en effet le 15 juin 2009 qu’elle adoptera un avis favorable, publié officiellement le 30 juin 20097. Fort de cet avis, la Commission européenne était en mesure de décider si elle souhaitait présenter aux États membres une décision d’autorisation ou de refus d’autorisation. A ce stade, le calendrier suivi par la Commission européenne commence à se distendre dans le temps. Sur base de l’avis des experts, la procédure8 prévoit que la Commission peut proposer aux États membres un refus ou une acceptation de délivrer l’autorisation. Si les États membres ne parviennent pas à une majorité, la proposition leur est représentée une seconde fois. Si, à nouveau, aucune majorité ne se dégage, la Commission européenne devient l’organe à qui appartient la décision finale. Elle peut adopter sa propre proposition ou la rejeter.
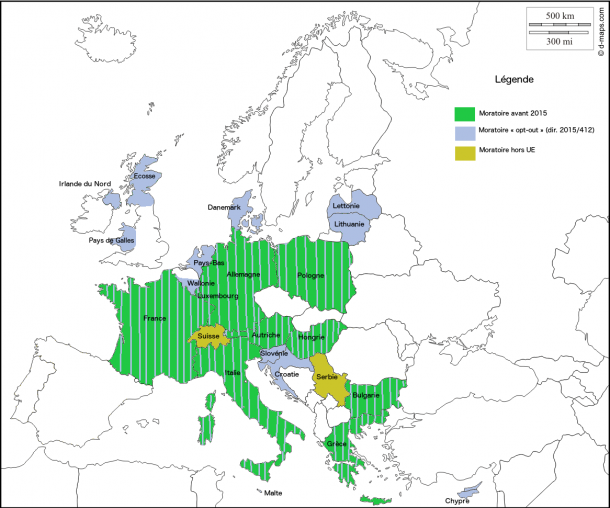
Dans le dossier de demande de renouvellement de l’autorisation de mise en culture commerciale du maïs Mon810, il faudra, à partir de l’avis de l’AESA rendu en 2019, attendre 8 années pour que les États membres reçoivent une proposition d’autorisation formulée par la Commission européenne. Il faut dire qu’entre temps, nombreux sont les États membres s’étant décidés à demander l’exclusion de leur territoire du champs géographique couvert par l’autorisation de 19989. Ils sont ainsi 18 États membres10 à avoir, fin 2015, demandé et obtenu une telle exclusion. La concomitance de ces interdictions en nombre est liée à l’adoption de directive 2015/41211. Si les États pouvaient auparavant interdire une culture d’OGM (via des clauses de sauvegarde – directive 2001/18 – ou des mesures d’urgence – règlement 1829/2003), le Conseil de l’Union européenne et le Parlement européen ont, en 2015, jugé « opportun d’accorder aux États membres davantage de souplesse pour décider s’ils veulent ou non que des OGM soient cultivés sur leur territoire »12.
C’est ainsi que le gouvernement français, par exemple, qui avait accordé l’autorisation initiale en 1998, demandait le 15 septembre 2015 « d’exclure l’ensemble du territoire français de l’autorisation octroyée à la société MONSANTO suite à la décision de la Commission 98/294/EC et au consentement final accordé le 3 août 1998 pour le maïs génétiquement MON810, pour ce qui concerne la mise en culture »13. Ils sont autant d’États, dont la France14, à avoir d’ores et déjà demandé à être exclus, en totalité ou en partie, du renouvellement de l’autorisation qui pourrait éventuellement intervenir.
Ces 18 États membres représentant au moins une majorité de 71,5 % au sein du Conseil de l’Union européenne, la Commission européenne a pu estimer qu’une proposition de renouvellement de l’autorisation initiale serait donc refusée. Car l’autorisation de culture initiale du seul et unique végétal transgénique serait alors devenue caduque. Pourtant, en 2017, 10 ans après avoir reçu la demande initiale de Monsanto de renouveler son autorisation de 1998, la Commission européenne choisira de faire voter le Conseil de l’Union européenne. Paradoxalement, le 27 janvier 201715, les États membres n’ont pas atteint de majorité pour refuser le renouvellement de l’autorisation du maïs Mon810 à la culture. Une absence de majorité qui fut à nouveau constatée le 27 mars 2017 suite à un second vote16.
Une disposition légale à l’avantage de Bayer/Monsanto
L’autorisation pour importer du maïs Mon810, comme celles délivrées cet été pour deux maïs de Corteva, montrent que la Commission européenne sait gérer un calendrier inférieur à 6 mois entre la réception de l’avis des experts européens sur les risques liés à un OGM et sa décision finale d’autorisation17. Mais, pour ce qui est de renouveler l’autorisation de la mise en culture du maïs Mon810, la Commission suit un autre calendrier. Les experts européens ayant rendu leur avis en juin 2009, la Commission pouvait, dans les deux mois qui suivaient, présenter une proposition favorable ou défavorable au renouvellement aux États membres. Elle mettra, nous l’avons vu, 10 ans…
Suite aux deux votes formels des États membres en 2017, votes qui débouchèrent sur une non décision, la Commission européenne est totalement libre de la décision finale. Elle peut décider de renouveler l’autorisation ou de refuser ce renouvellement. Cette liberté lui est acquise depuis le 27 mars 2017. Mais, à ce jour, bientôt 8 ans plus tard, aucune décision n’a été prise. Interrogée par courrier électronique par Inf’OGM, la Commission européenne nous a répondu le 24 octobre 2024 « réfléchir à la marche à suivre », précisant que « Conformément au règlement (CE) n° 1829/2003, la période d’autorisation est automatiquement prolongée jusqu’à ce qu’une décision soit prise sur son renouvellement ».
En effet, dans son article 11, le règlement 1829/2003 établit que « lorsque, pour des raisons indépendantes de la volonté du titulaire de l’autorisation, aucune décision n’est prise quant au renouvellement d’une autorisation avant la date d’expiration de celle-ci, la durée d’autorisation du produit est prolongée automatiquement jusqu’à ce qu’une décision soit prise ». A nouveau interrogée par Inf’OGM pour connaître les raisons qui ont poussé la Commission à ne pas se décider en 7 ans, la Commission nous réaffirmait le 28 octobre 2024 continuer « à évaluer la meilleure façon de procéder », ajoutant ne pas pouvoir « partager d’autres informations à ce stade ». Une précision fondamentale doit être apportée ici : la Commission européenne n’est tenue par aucun délai légal pour prendre sa décision. Les textes réglementaires n’ont en effet pas prévu d’imposer à la Commission européenne de statuer sous une période de temps donnée une fois que les États membres ont voté. Cette situation interpelle d’autant plus que si la Commission devait délivrer le renouvellement d’autorisation de la culture commerciale du maïs Mon810, elle le ferait en 2024 sur base d’un dossier déposé en 2007, comportant donc des données scientifiques datant de 17 ans…
A l’image de la procédure appliquée aux pesticides18, que la Commission européenne délivre un renouvellement d’autorisation formel ou qu’elle ne réponde pas à la demande de Bayer/Monsanto déposée en 2007, l’autorisation initiale reste valide et le maïs Mon810 peut continuer à être cultivé dans les États membres qui ne l’ont pas interdit. Or, d’une part, l’Union européenne ne reçoit quasiment plus de demandes d’autorisation de mise en culture commerciale d’OGM, et, d’autre part, la Commission a proposé une déréglementation d’un grand nombre d’entre eux en 2023. Au regard de ces deux faits, il semble que la Commission ait décidé de ne pas prendre le risque de cristalliser le débat en apparaissant défendre la mise en culture des OGM transgéniques dans une Union européenne qui a majoritairement fait le choix de les faire cultiver ailleurs. D’autant que, tant qu’elle ne répond pas, la culture commerciale de ce maïs est toujours légale même si les surfaces diminuent d’années en année19. Le silence est d’or pour la Commission (et Bayer/Monsanto).
D’autres demandes de 1ère autorisation entre les mains de la Commission
Le registre européen des demandes d’autorisation à la culture d’OGM selon la procédure 2001/18 fait également état de trois demandes « en cours » . La demande d’Amylogène pour sa pomme de terre transgénique à composition en amidon modifiée, déposée en 1996, a été retirée par l’entreprise. Mais Syngenta est toujours en attente d’une réponse à sa demande faite, en 1996, pour la culture de son maïs Bt11. Dow Agrosciences (devenue depuis Corteva) est, de son côté, en attente depuis 2001 pour son maïs TC150720. Dans les deux cas, l’AESA a rendu ses opinions (favorables) sur les risques liés à la culture de ces maïs en 2005.
Contrairement au maïs Mon810, ce ne sont pas 10 années mais 12 qu’il aura fallu à la Commission européenne pour soumettre aux votes des États membres, en 2017, une réponse positive à ces deux demandes d’autorisation. Mais ces 27 janvier21 et 27 mars 201722, aucune majorité qualifiée n’a pu être obtenue par les États. La Commission européenne dispose donc à ce jour de la décision finale pour autoriser ou refuser d’autoriser la culture commerciale de ces deux maïs transgéniques.
1 Union européenne, « Décision d’exécution (UE) 2024/1828 de la Commission du 2 juillet 2024 renouvelant l’autorisation de mise sur le marché d’aliments pour animaux contenant du maïs génétiquement modifié MON 810 ou consistant en ce maïs et de produits destinés à l’alimentation humaine ou animale produits à partir de celui-ci, en application du règlement (CE) no 1829/2003 du Parlement européen et du Conseil, et abrogeant la décision d’exécution (UE) 2017/1207 de la Commission [notifiée sous le numéro C(2024) 4493] », Journal officiel de l’Union européenne, 4 juillet 2024.
2 Commission européenne, « 98/294/CE: Décision de la Commission du 22 avril 1998 concernant la mise sur le marché de maïs génétiquement modifié (Zea mays L. lignée MON 810), conformément à la directive 90/220/CEE du Conseil (Texte présentant de l’intérêt pour l’EEE) », Journal officiel de l’Union européenne, 5 mai 1998.
3 République française, « Arrêté du 3 août 1998 portant consentement écrit, au titre de l’article 13, paragraphe 4, de la directive 90/220/CEE du 23 avril 1990, des décisions 98/293/CE et 98/294/CE du 22 avril 1998 concernant la mise sur le marché de maïs génétiquement modifiés (Zea mays L. T 25 et MON 810) », JORF, 5 août 1998.
4 Règlement 1829/2003, article 11, « Renouvellement des autorisations – 1. Les autorisations accordées en vertu du présent règlement sont renouvelables pour des périodes de dix ans, sur demande adressée à la Commission par le titulaire de l’autorisation au plus tard un an avant la date d’expiration de celle-ci ».
5 Monsanto Company, « Application for renewal of the authorisation for continued marketing of existing MON 810 maize products that were authorized under Directive 90/220/EEC (Decision 98/294/ EC) and subsequently notified in accordance to Article 20(1)(a) of Regulation (EC) No 1829/2003 on genetically modified food and feed », mai 2007.
6 Commission européenne, Direction générale de la santé et de la sécurité alimentaire, « Applications for renewal of authorisation for continued marketing of existing feed consisting and/or containing MON810 maize for feed use (including cultivation) that were authorized nder Directive 90/220/EEC (Decision 98/294/EC) and subsequently notified according to Article 20(1)(a) of Regulation (EC) No 1829/2003 on genetically modified food and feed », 29 juin 2007.
7 « Scientific Opinion of the Panel on Genetically Modified Organisms on applications (EFSA-GMO-RX-MON810) for the renewal of authorisation for the continued marketing of (1) existing food and food ingredients produced from genetically modified insect resistant maize MON810; (2) feed consisting of and/or containing maize MON810, including the use of seed for cultivation; and of (3) food and feed additives, and feed materials produced from maize MON810, all under Regulation (EC) No 1829/2003 from Monsanto », The EFSA Journal, Volume7, Issue6, p.1–85, juin 2009.
8 Pauline Verrière, « UE – Nouvelle comitologie : le changement dans la continuité », Inf’OGM, 22 mars 2016.
9 Commission européenne, « Restrictions of geographical scope of GMO applications/authorisations: EU countries demands and outcomes ».
10 Autriche, Région de Wallonie (Belgique), Bulgarie, Croatie, Chypre, Danemark, France, Allemagne, Grèce, Hongrie, Italie, Lettonie, Lituanie, Luxembourg, Malte, Pays-Bas, Pologne, Slovénie.
Ils étaient 19 États en 2015 mais, depuis, le Royaume-Uni a quitté l’Union européenne.
11 Union européenne, « Directive (UE) 2015/412 du Parlement européen et du Conseil du 11 mars 2015 modifiant la directive 2001/18/CE en ce qui concerne la possibilité pour les États membres de restreindre ou d’interdire la culture d’organismes génétiquement modifiés (OGM) sur leur territoire Texte présentant de l’intérêt pour l’EEE », Journal officiel de l’Union européenne, 13 mars 2015.
12 Ibid. (voir le considérant 8 de la directive 2015/412).
13 République française, « NOTE DES AUTORITÉS FRANÇAISES – OBJET : Mise en culture d’OGM – Demande d’exclusion du territoire français », 15 septembre 2015.
14 République française, « NOTE DES AUTORITES FRANÇAISES – OBJET : Mise en culture d’OGM – Demande d’exclusion du territoire français », 15 septembre 2015.
15 Commission européenne, Direction générale de la santé et de la sécurité alimentaire, « SUMMARY REPORT OF THE JOINT MEETING – STANDING COMMITTEE ON PLANTS, ANIMALS, FOOD AND FEED – Section Genetically Modified Food and Feed and Environmental Risk and REGULATORY COMMITTEE under DIRECTIVE 2001/18/EC HELD IN BRUSSELS ON 27 JANUARY 2017 », 27 janvier 2017.
16 Commission européenne, Direction générale de la santé et de la sécurité alimentaire, « SUMMARY REPORT OF THE APPEAL COMMITTEE – Genetically Modified Food and Feed Regulatory Committee 2001/18/EC », 27 mars 2017.
17 Concernant les maïs DP915635 et DP023211 de Corteva, voir :
Eric Meunier, « Transgenèse, Crispr/Cas9, ARNi… package total pour deux maïs OGM ! », Inf’OGM, 29 octobre 2024.
18 Pollinis, « PESTICIDES : LE SYSTÈME DE PROLONGATIONS SANS FIN DE L’UE MENACE LA BIODIVERSITÉ », 13 juillet 2023.
19 Christophe Noisette, « Les cultures transgéniques en voie de disparition dans l’UE », Inf’OGM, 8 avril 2024.
20 Commission européenne, « Deliberate Release and Placing on the EU Market of GMOs – GMO Register / Notifications authorized under Directive 2001/18/EC – GMO Part C ».
21 Commission européenne, Direction générale de la santé et de la sécurité alimentaire, « SUMMARY REPORT OF THE JOINT MEETING – STANDING COMMITTEE ON PLANTS, ANIMALS, FOOD AND FEED – Section Genetically Modified Food and Feed and Environmental Risk and REGULATORY COMMITTEE under DIRECTIVE 2001/18/EC HELD IN BRUSSELS ON 27 JANUARY 2017 », 27 janvier 2017.
22 Commission européenne, Direction générale de la santé et de la sécurité alimentaire, « SUMMARY REPORT OF THE APPEAL COMMITTEE – Genetically Modified Food and Feed Regulatory Committee 2001/18/EC », 27 mars 2017.