Les entreprises testent la flexibilité de la législation européenne sur les OGM
Si les procédures d’autorisation commerciale de Plantes Génétiquement Modifiées (PGM) n’ont pas changé ces derniers mois, de récentes demandes d’autorisation montrent qu’elles ne sont pas toujours respectées. Après avoir relaté les défauts de deux dossiers récents dans son numéro précédent, Inf’OGM suit aujourd’hui deux nouveaux cas de figure : un seul dossier déposé pour deux PGM et non une seule, et des demandes d’autorisation pour la seule culture déposées selon le règlement 1829/2003.
Dans son précédent numéro [1], Inf’OGM faisait état du constat du Haut Conseil sur les Biotechnologies (HCB) quant à l’insuffisance de deux dossiers de demande d’autorisation : celui de la pomme de terre Modena (Avebe) et celui du maïs Mir604 (Syngenta). Pour le HCB, aucune conclusion quant aux risques associés à l’utilisation de ces PGM ne peut être tirée des dossiers soumis ! Dans ce numéro, ce sont deux nouvelles approches administratives des demandes d’autorisation qui sont présentées.
Un choix de procédure simplifié
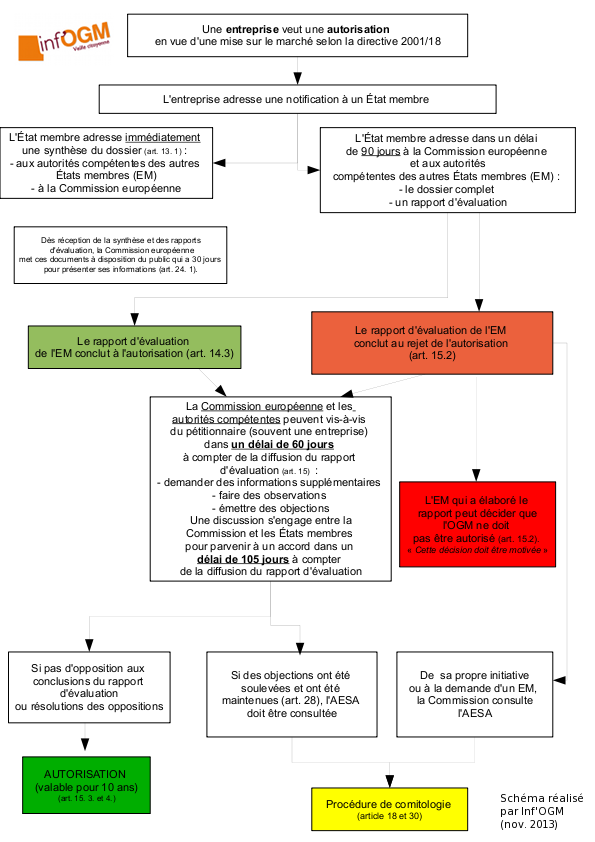
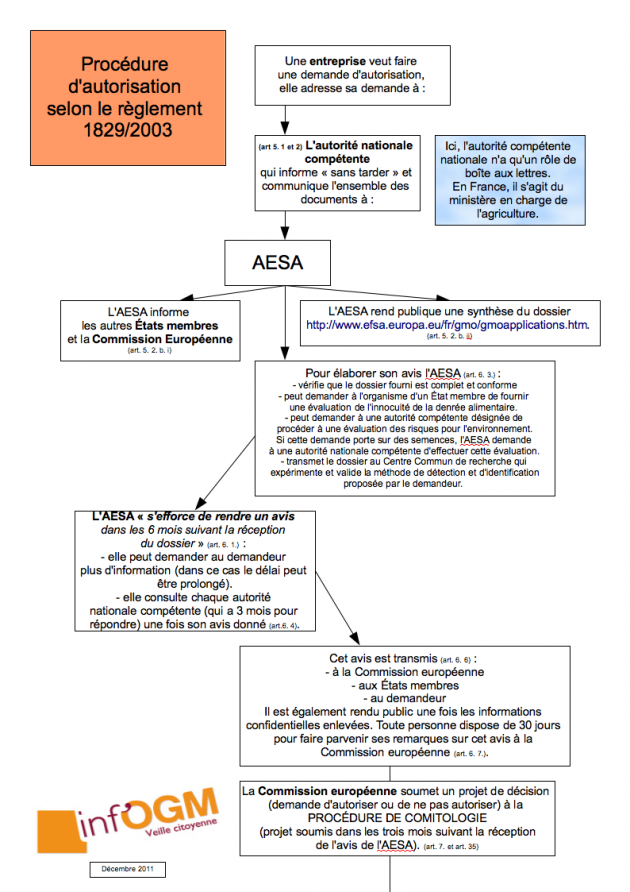
Pour obtenir une autorisation de commercialisation d’une PGM dans l’UE, les entreprises ont le choix entre deux procédures : la 2001/18 ou la 1829/2003 (du nom des textes législatifs les définissant : la directive 2001/18 « relative à la dissémination volontaire d’OGM dans l’environnement » et le règlement 1829/2003 « concernant les denrées alimentaires et les aliments pour animaux GM »). En théorie, les demandes d’autorisation pour l’alimentation humaine ou animale doivent être déposées selon la procédure 1829/2003 et les demandes d’autorisation à la culture doivent suivre la 2001/18. Mais les différences entre ces deux procédures ne s’arrêtent pas à ce qu’elles autorisent. De fait, la 1829/2003 est moins contraignante que la 2001/18 : surveillance sanitaire après commercialisation non obligatoire (2), interdictions nationales possibles mais plus encadrées, information du public moins exigeante… [2]. Les entreprises essayent donc d’obtenir leurs autorisations commerciales selon la procédure 1829/2003 plutôt que par la procédure 2001/18. Ceci afin, évidemment, de faire face à moins de contraintes.
Jusqu’en 2008, la manière pour les entreprises d’obtenir une autorisation selon la procédure 1829/2003 était de profiter du principe européen « une porte une clef ». Selon ce principe, en couplant au sein du même dossier administratif la culture à l’alimentation, les entreprises avaient – et ont toujours – le droit de déposer leur demande selon la seule procédure 1829/2003 [3].
Mais depuis 2008, six dossiers de demandes d’autorisation de PGM destinées uniquement à la culture [4] ont été déposés selon la procédure 1829/2003. Parmi ces six PGM, certaines ont déjà été autorisées à l’alimentation et d’autres ont une autre demande pour l’alimentation en cours. Mais il s’agit bien de dossiers administrativement différents et non du même dossier contenant une demande pour la culture et pour l’alimentation ! Destinées uniquement à la culture, le principe « une porte une clef » ne s’applique donc pas à ces PGM et les dossiers auraient dû être déposés selon la procédure 2001/18. Mais les entreprises interprètent le règlement 1829/2003 (on le rappelle, qui concerne les PGM destinés à l’alimentation humaine et animale) comme concernant également la culture de PGM lorsque ces dernières sont destinées à l’alimentation. Si sur le plan juridique, l’interprétation du droit paraît au moins discutable, c’est politiquement que des questions se posent. Car si les autorisations pour une mise en culture peuvent effectivement être déposées selon la seule procédure 1829/2003, la directive 2001/18 voit sa pertinence législative réduite à la seule gestion des essais expérimentaux en champ. Et les différences observées entre la directive 2001/18 et le règlement 1829/2003 [5] prennent une toute autre ampleur.
Un dossier pour deux plantes
Autre « nouveauté » réglementaire, un dossier unique déposé pour deux PGM différentes : le dossier NL/2011/94, déposé au Pays-Bas par Bayer pour les cotons GHB614*LL25*Mon15985 et LL25*Mon15985. Comme l’a confirmé la Commission européenne à Inf’OGM, la législation européenne impose pourtant qu’un dossier de demande d’autorisation commerciale soit déposé pour chaque PGM. C’est la gestion au cas par cas (par plante et par événement ou combinaison d’évènements transgéniques au sein d’une seule et même plante). Dans le cas de ces deux cotons, il est pourtant à noter qu’un dossier avait bien été déposé pour le seul coton LL25*Mon15985 en 2006 (dossier NL/2006/35) mais ce dossier avait été retiré par l’entreprise. Cette dernière nous a expliqué avoir retiré le dossier NL/2006/35 en 2009 pour joindre le coton LL25*Mon15985 au dossier du coton LL25*Mon15985*GHB614, sur demande de l’Agence Européenne de Sécurité des Aliments (AESA) ! Une réponse qui ne va pas dans le sens de la réponse fournie par la Commission européenne à Inf’OGM, expliquant qu’au printemps 2011, Bayer a reçu une lettre informelle de l’AESA lui demandant de scinder le dossier NL/2011/94 pour les deux cotons en deux dossiers, un pour chaque coton. Si cette demande est actuellement en cours de discussion comme le confirme Bayer, la question se pose d’ores et déjà de savoir qui gère administrativement les demandes d’autorisation, la Commission européenne ou l’AESA ? Inf’OGM a interrogé l’AESA pour obtenir des explications et la réponse à venir fera l’objet d’un prochain article.
Les deux constats présentés ici se rejoignent en ce qu’ils concernent tous des demandes d’autorisation commerciale pour des PGM. Alors qu’une révision complète de la législation européenne sur les PGM est annoncée pour 2012 et que de nombreux chantiers sont en cours (lignes directrices d’évaluation des risques, tolérance zéro, plan de surveillance post commercialisation…), ces constats d’une flexibilité certaine des procédures d’autorisation ne devraient pas rassurer les acteurs qui se sont battus pour un encadrement strict de ces plantes.