Actualités
Embryons « de synthèse » humains… embryons vraiment ?
Arrivés sur la scène médiatique à l’été 2022, les articles scientifiques qui s’intéressent aux embryons « de synthèse » humains font depuis boule de neige. Ces embryons « de synthèse » sont issus de biotechnologies et d’ingénierie qui miment et artificialisent, à l’extrême, la biologie de la reproduction humaine. Sous couvert de médecine, ils préparent en fait l’Homme augmenté. En juin 2023, s’est tenue une réunion de la Société Internationale pour la Recherche sur les Cellules Souches (ISSCR en anglais), qui a fait parler à nouveau des embryons « de synthèse ».
Liées aux capacités croissantes des techniques et grâce à l’afflux de capitaux, les recherches dites biomédicales s’emballent. Nous essaierons de comprendre comment la recherche biomédicale est arrivée à ce niveau d’artificialisation des embryons de mammifères, quelles en sont les promesses pour l’espèce humaine, les enjeux éthiques et législatifs dans le contexte économique actuel.
De petits pas en petits pas : organoïdes, blastoïdes, embryoïdes
La culture de cellules in vitro qui se fait à plat en 2D dans une boite de Pétri cède peu à peu la place, dans le domaine médical, à la culture en 3D. En effet, on peut construire dans un milieu de culture imitant le milieu extracellulaire (hydrogel contenant un cocktail moléculaire adapté) des mini-organes ou organoïdes « qui ont des architectures et des fonctionnalités qui se rapprochent de celles des tissus dont ils dérivent » [1]. Ces organoïdes sont issus, soit de cellules souches très peu différentiées des tissus d’un organe donné, soit de cellules souches dites « induites » (ou iPS) [2]. « L’auto-organisation spontanée de cellules en 3D, bien qu’en progression par rapport à la 2D, est encore loin de retranscrire la fonctionnalité de l’organe au complet, d’où l’idée de diriger la formation de l’organoïde par bioimpression » [3]. On obtient des copies réduites d’organes mais elles sont encore très imparfaites. Ainsi, un pseudo cœur a été construit à partir des propres cellules d’un patient, mais aucune transplantation n’est possible à ce jour (risques de rejet, anomalies et cancers) [4].
En dehors des promesses de greffes, les organoïdes se justifient en recherche fondamentale pour comprendre les processus de construction des différents tissus au sein des organes. Ce sont aussi des « outils » technologiques, sur lesquels on peut, par exemple, tester la toxicité de certaines molécules (médicaments, perturbateurs endocriniens…) ou mimer des maladies comme les cancers. Comparés aux modèles animaux, les organoïdes présentent un avantage pour les chercheurs : « Comme ils sont obtenus à partir de matériel humain, ils sont plus prédictifs de la façon dont se développe une maladie chez l’homme, ou de sa réponse à une infection ou encore à des traitements médicamenteux » [5]. Il reste cependant deux écueils majeurs : d’une part, on ne sait pas reproduire tous les tissus donc tous les organes et, d’autre part, « ces organes de synthèse s’étant développés en dehors du corps, sans les interactions naturelles avec les autres organes, ils ont forcément des propriétés différentes » [6]. Les modèles d’impression 3D de l’humain sont donc aussi limités que les modèles animaux.
Les questions éthiques deviennent parfois vertigineuses : ces « outils » que sont les organoïdes seront-ils vendables, vendus, brevetés ? Des cérébroïdes (« qui ressemblent au cerveau »), s’ils sont un jour construits dans leur complexité (encore largement inconnue), seront-ils doués de sensibilité ? de conscience ? Quels fantasmes nourrit-on par rapport à ces questions là ?
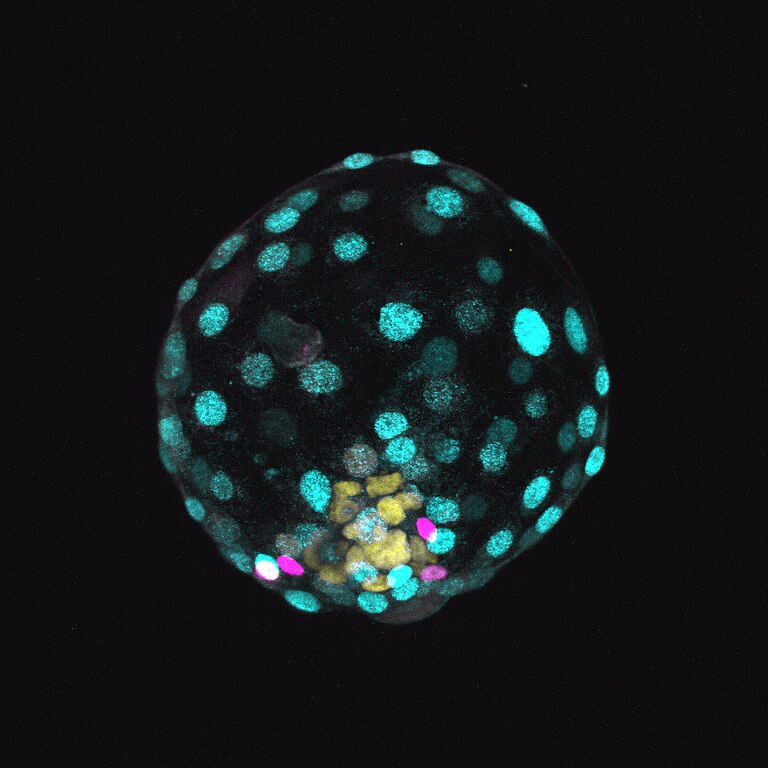
Dans la foulée, d’autres structures ont été mimées : « des modèles embryonnaires à usage scientifique » disent les chercheurs [7]. Ce furent d’abord des constructions mimant les blastocytes humains, embryons de 6-7 jours après la fécondation et avant leur implantation dans l’utérus. Un chercheur français, Nicolas Rivron (Académie des Sciences de Vienne) travaille sur ces structures précoces nommées blastoïdes [8]. Comme pour les organoïdes, les cellules souches utilisées peuvent être des cellules souches « induites » (iPS) [9] ou des cellules souches embryonnaires humaines issues de lignées de cellules déjà établies. Ces lignées, parfois très anciennes, ont été obtenues à partir d’embryons humains surnuméraires, issus de fécondations in vitro (FIV) ne répondant plus à un projet parental [10].
Le but affiché de ces modèles embryonnaires est à la fois scientifique et médical : comprendre le développement très précoce de l’embryon humain et les causes des avortements spontanés fréquents au cours de cette étape afin de les éviter. Mais aussi d’étudier les « effets des mutations génétiques et des toxines, ainsi que le développement de nouvelles thérapies associées à la fécondation in vitro », nous dit Xiaodong Liu, auteur d’une publication australienne sur le sujet [11]. Pourtant, le même affirme que « le développement de nos blastoïdes est bien moins efficace que celui des blastocystes ». Pourquoi alors tenter des expériences sur ces modèles, s’ils ne sont pas bons ? Pour faire progresser les techniques ? Par curiosité ?
Au sujet de ces blastoïdes, une étude récente nous montre la volonté d’aller plus loin [12]. Elle propose des pistes pour tenter d’implanter ces copies embryonnaires chez la souris et chez l’Homme… toujours pour « comprendre ». Est-ce sûr ?
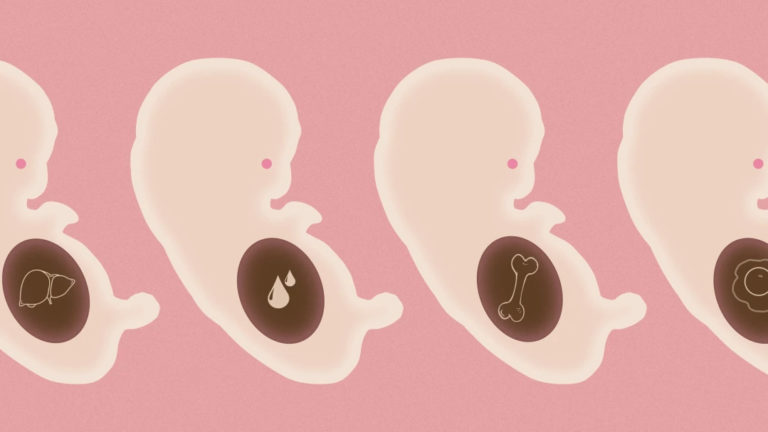
En 2022, l’équipe israélienne du biologiste Jacob Hanna (Institut Weizmann des Sciences) a franchi un autre cap [13]. Après avoir travaillé à partir de cellules souches embryonnaires, elle a utilisé des cellules iPS. Elle a développé des structures similaires à un embryon de souris de huit jours et demi, soit plus d’un tiers de la gestation. À ce stade, les organes de l’embryon et les annexes embryonnaires (amnios, futur placenta…) commencent à se différencier, ce qui était loin d’être le cas des blastoïdes, beaucoup trop jeunes. Le chercheur français Laurent David (Université de Nantes), spécialiste du développement des cellules souches parle d’embryoïdes, car ces copies ne présentent que des « ébauches » d’organes.
De telles ébauches intéressent les chercheurs [14]. Elles sont en effet intégrées dans un organisme, ici artificiel où les communications entre cellules, entre tissus et organes modèlent ces derniers et sont censés assurer leurs fonctionnalités, au contraire des organoïdes cultivés séparément.
Pour les embryoïdes, un « utérus artificiel » a été mis en place à l’Institut Weizmann. De très nombreux critères sont pris en compte, copiés sur les conditions utérines : température, environnement chimique, oxygénation, agitation… Les études sur l’espèce souris sont faites pour une transposition dans l’espèce humaine : l’utérus artificiel humain devient indispensable.
Jacob Hanna a fondé une start up : Renewal Bio. La revue MIT Technology l’annonce : « Dans le cadre de la recherche de nouvelles formes de médecine de la longévité, une société de biotechnologie basée en Israël déclare qu’elle a l’intention de créer des versions embryonnaires de personnes afin de prélever des tissus pour les utiliser dans des traitements de transplantation » [15]. Les ébauches d’organes, devenus organes à un stade plus avancé de l’embryon, serviront à faire des autogreffes, des pièces de rechange propres à un individu. Cela sera possible même si « les embryons de synthèse sont semblables à 95% aux embryons naturels » [16]. Sur quels critères se base cette similarité ? Et que valent les 5% restants ? Ils peuvent très bien jouer sur des propriétés fondamentales des organes. Nous sommes dans l’ère du virtuel et du transhumanisme et dès lors les publications scientifiques emploient le terme d’« embryons de synthèse ».
Les embryons de synthèse sont-ils des embryons ?
« Ce ne sont pas des embryons », tranche le chercheur français Laurent David : « jusqu’à preuve du contraire, ils ne donnent pas un individu viable et capable de se reproduire ». De même, Jacob Hanna le dit : « l’idée n’est pas de produire des mini-moi ».
Dans un récent article de Nature, Alfonso Martinez Arias, biologiste à l’université Pompeu Fabra de Barcelone, affirme que les résultats décrits ne peuvent en aucun cas être considérés comme analogues à de véritables embryons : « Ce que nous voyons, ce sont des masses de cellules séparées en compartiments, mais pas d’organisation semblable à celle d’un embryon », explique-t-il [17]. Mais tout cela tente de s’en rapprocher : modestie feinte ?
Cela nous amène à la définition d’un embryon. Chez les mammifères, un embryon résulte du développement de la cellule œuf issue de la fécondation d’un ovocyte par un spermatozoïde. Ce n’est pas le cas des embryons artificiels issus de cellules iPS (génétiquement reprogrammées). Jacob Hanna précise bien : « l’objectif est aussi de s’affranchir des cellules souches embryonnaires qui ont été la source initiale des embryoïdes » [18]. En effet, la législation sur les cellules souches embryonnaires est la même que celle des embryons dans de très nombreux pays et elle est restrictive : toute création d’embryons humains (issus de fécondation) est interdite (même si les embryons surnuméraires des FIV peuvent être utilisés avec consentement parental pendant 14 jours puis détruits) [19]. Les chercheurs et leurs entreprises, telle Renewal Bio, ont donc les coudées franches et pourront concéder des licences sur leurs droits de propriété intellectuelle, leurs embryons n’en étant pas.
Par contre, si les embryons artificiels proviennent de lignées de cellules souches embryonnaires humaines, ils résultent bien d’une fécondation (FIV). Ce sont donc des embryons et le caractère restrictif de la loi devrait faire effet. Or, en mai 2021, la Société internationale de recherche sur les cellules souches (ISSCR) a publié de nouvelles recommandations en terme de culture d’embryons humains in vitro [20]. Pour les 45 membres de l’ISSCR à l’origine de ces recommandations, la limite de 14 jours en vigueur actuellement « doit être allongée pour faire progresser les connaissances ». Aucune nouvelle limite n’est proposée.
Magdalena Zernica-Goetz, biologiste à l’université de Cambridge (Royaume-Uni) travaille aussi sur ces modèles. Elle estime cependant que l’heure n’est pas encore « aux commercialisations ». Néanmoins, la bataille des brevets sur « les applications en lien avec les découvertes » a déjà commencé entre les deux équipes israélienne et londonienne. Et Magdalena Zernica -Goetz pointe déjà le prochain défi : « il sera essentiel d’avoir aussi un placenta synthétique » [21].
Une recherche scientifiquement controversée
Nicolas Rivron, Magdalena Zernica-Goetz et, globalement, la communauté médicale défendent ces modèles d’embryons pour permettre de comprendre les causes d’infertilité et les anomalies ou maladies du développement embryonnaire. En espérant les rendre effectifs.
Laurent David, par contre, se montre très critique quant à l’utilisation des organes ou tissus issus de ces modèles : « Dans le domaine de la clinique, les procédures sont tellement lourdes qu’au regard de la complexité et de l’hétérogénéité des tissus obtenus, ce ne sera pas compétitif par rapport aux banques de cellules souches par exemple » .
Quant à l’efficacité des cellules iPS à construire des modèles fiables d’embryons, on peut en douter. En effet, la reprogrammation génétique des cellules somatiques peut induire des mutations d’ampleur variée pouvant altérer le fonctionnement des cellules dérivées des iPS. En outre, la reprogrammation des cellules est parfois incomplète : les cellules iPS peuvent présenter des anomalies acquises au cours de leur vie antérieure, avant d’être dé-différentiées, notamment des signaux épigénétiques… [22]. Les cellules souches embryonnaires ont encore de beaux jours devant elles.
Embryons artificiels : pourquoi se préoccuper d’éthique ?
Deux problèmes éthiques se posent et se rejoignent.
Le premier, celui des embryons, réserves d’organes, dont les données seront même numérisées [23]. Il s’agit d’abord de réparer les défaillances physiologiques humaines, mais se profile la possibilité d’avoir des organes toujours jeunes prolongeant la vie humaine, comme le vend la start up de Jacob Hanna. C’est de l’eugénisme.
Le deuxième problème est celui de la reproduction artificielle de l’humain qui devient un processus technique, destiné à être optimisé. En effet, l’article de Nature souligne « qu’une étude récente sur des modèles d’embryons de singes a montré que ces modèles pouvaient induire une grossesse – qui s’est interrompue spontanément après – s’ils étaient placés dans l’utérus » [24]. Cela n’a pas marché mais a été pensé. La transplantation dans l’utérus est bien envisagée dans l’espèce humaine, soit disant pour étudier comment l’embryon naturel (que ces modèles ne sont pas) se fixe dans l’utérus. Cela semble bienveillant. Mais certains chercheurs risquent d’être tentés de faire naître ces embryons artificiels. L’objectif serait bien alors de créer la vie, dans une posture de contrôle total et de toute puissance scientifique. Donc de réduire la vie à ne plus être qu’un produit d’une nouvelle industrie. Des corps, hommes ou femmes, sans héritage générationnel ou historique naîtraient : un bond dans l’inconnu bien peu désirable.
Dans leur volonté de faire des ersatz de la réalité, ces chercheurs promettent d’améliorer la réalité, mais on peut craindre qu’ils veuillent lui substituer leur production artificielle.
[1] Inserm, « Organoïdes : quelle place dans la recherche de demain ? », 2019.
[2] Les cellules iPS sont des cellules somatiques adultes qui ont été génétiquement modifiées pour revenir à un stade non différencié. Les embryons qui en sont dérivés sont des clones de l’individu sur lesquels ces cellules ont été prélevées. En savoir plus :
![]() , « Bioéthique : qu’est-ce qui se cache derrière les cellules iPS ? », Inf’OGM, 10 février 2020 ;
, « Bioéthique : qu’est-ce qui se cache derrière les cellules iPS ? », Inf’OGM, 10 février 2020 ;
![]() , « Bioéthique et esprit de la loi : des garde-fous bien fragiles », Inf’OGM, 29 juillet 2021.
, « Bioéthique et esprit de la loi : des garde-fous bien fragiles », Inf’OGM, 29 juillet 2021.
[3] Inserm, Ibid.
[4] Alcimed, « Impression 3D en santé : l’avancée du cœur en bio-impression 3D », 30 mars 2021.
[5] Bourdet, J., « Les organoïdes : de mini-organes aux maxi-pouvoirs », Journal du CNRS, 25 août 2022.
[6] Bourdet, J., Ibid.
[7] Comité d’éthique de l’Inserm, « La recherche sur les embryons et les modèles embryonnaires à usage scientifique », janvier 2019.
[8] Nicolas Rivron (à l’origine du mot blastoïde) : https://www.blastoid.org/
[9] Ces cellules iPS vont donner un blastoïde qui ne sera donc pas issu d’une fécondation.
[10] Florence Rosier, « Planète », page 9, Le Monde, 19 mars 2021.
[11] Liu, X. et al., « Modelling human blastocysts by reprogramming fibroblasts into iBlastoids », Nature, 2021 Mar ;591(7851):627-632.
[12] Kagawa, H., et al., « Human blastoids model blastocyst development and implantation », Nature, 601, 600–605 (2022).
[13] Tarazi, S., « Post-gastrulation synthetic embryos generated ex utero from mouse naive ESCs », Cell, Volume 185, issue 18, septembre 2022.
[14] Laurent David, Université de Nantes, « Plateforme iPSC Nantes – Cellules souches pluripotentes induites », janvier 2023.
[15] Regalado A., « This startup wants to copy you into an embryo for organ harvesting », MIT Technology Review, 4 août 2022.
[16] Tarazi, S., « Post-gastrulation synthetic embryos generated ex utero from mouse naive ESCs », Cell, Volume 185, issue 18, septembre 2022.
[17] Ball, P., « Most advanced synthetic human embryos yet spark controversy », Nature, 20 juin 2023.
[18] Clothilde Mraffko et Hervé Morin, « Les premiers embryons synthétiques développés ex utero atteignent le stade de la croissance d’organes », Le Monde, 6 septembre 2022.
[19] , « Bioéthique et esprit de la loi : des garde-fous bien fragiles », Inf’OGM, 29 juillet 2021.
[20] Généthique, « Recherche sur l’embryon : plus aucune limite ? », 27 mai 2021.
[21] Clothilde Mraffko et Hervé Morin, « Les premiers embryons synthétiques développés ex utero atteignent le stade de la croissance d’organes », Le Monde, 6 septembre 2022.
[22] Inserm, « Cellules souches pluripotentes induites (IPS) : un outil formidable pour la recherche… qui va révolutionner les nouvelles thérapies », 13 décembre 2019.
[23] ,
,
, « Vivant numérisé et technologisé : ayez confiance ou taisez-vous ! », Inf’OGM, 11 mars 2021.
[24] Ball, P., « Most advanced synthetic human embryos yet spark controversy », Nature, 20 juin 2023.